近日,我院孟忠吉教授团队联合德国埃森大学医院陆蒙吉教授团队在国际权威期刊Autophagy(中科院一区,IF 16.016)上发表了一篇题为CCDC88A/GIV promotes HBV replication and progeny secretion via enhancing endosomal trafficking and blocking autophagic degradation的文章,阐述了乙型肝炎病毒(Hepatitis B virus, HBV)在分泌过程中的囊泡转运新途径(1)。孟忠吉教授和陆蒙吉教授为共同通讯作者,王雪玉博士为第一作者,我院生物医学研究所的魏志强为共同第一作者,十堰市太和医院为第一单位。

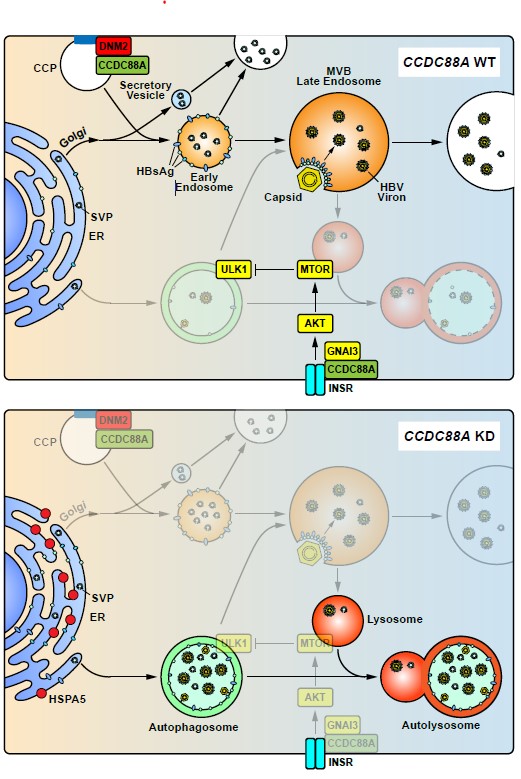
HBV感染目前仍是一项重大的公共卫生挑战,全球大约有2.5亿慢性HBV感染者。目前核苷类似物(Nucleoside Analogues,NAs)治疗只能控制病毒复制,但不能清除cccDNA和HBsAg。干扰素治疗仅在10-30%的患者中有效应答,且副作用明显,优化治疗后,也只有少数患者能实现 “功能性治愈”。因此,研究完善HBV的生活史,对寻找新的治疗靶点具有重要的意义。自噬在HBV的复制和自然史中发挥重要作用(2)。但自噬体在HBV生活史中扮演怎样的角色,尚未阐明。研究者在体外肝癌细胞系中通过过表达和敲降CCDC88A来研究CCDC88A对HBV调控作用。结果表明,过表达CCDC88A促进HBV的复制和分泌,而敲降CCDC88A与之相反。有趣的是,siRNA敲降CCDC88A使HBsAg聚集在细胞核周,但对HBcAg的亚细胞定位无影响。此外,CCDC88A在体外促进内体形成,但抑制自噬体形成。由于前期研究表明自噬体的增加促进HBV复制,因此研究者推测CCDC88A通过调控内体运输促进HBV的复制和分泌。研究者进一步通过抑制或阻断胞吞和内体运输下游分子DNM2(CCDC88A的靶蛋白)、CLTC和RAB5A,证实了这一推测。在机制上,通过敲降CCDC88A等一系列手段抑制内体形成,阻断新生成的HBsAg从内质网上向内体运输,使其聚集在内质网上(即核周),从而激活内质网应激和未折叠蛋白反应,进而激活自噬流通和促进HBV的自噬性降解。此外,CCDC88A和它的另一个靶蛋白GNAI3通过增强胰岛素诱导的Akt-mTOR信号通路,抑制自噬流通和HBV的自噬性降解。
以上结果表明,CCDC88A介导的内体运输在HBV复制和分泌过程中发挥重要作用。基于上述研究,研究者提出HBV囊泡转运的如下假说:HBsAg在内质网合成后,主要通过早期内体-晚期内体/多囊体途径运输,在HBsAg大量表达造成内质网应激的情况下也会利用自噬体-晚期内体/多囊体或自噬体-溶酶体作为补充途径;而核心颗粒在晚期胞体/多囊体表面,借助镶嵌在膜表面的HBsAg进入多囊体中;成熟的病毒颗粒通过多囊体与细胞膜融合分泌出去。总的来说,该研究提出了HBV囊泡转运的新观点,加深了我们对HBV生活史的了解。
原文链接:
https://www.tandfonline.com/doi/abs/10.1080/15548627.2021.1934271?journalCode=kaup20
参考文献
1. Wang X, Wei Z, Lan T, He Y, Cheng B, Li R, Chen H, et al. CCDC88A/GIV promotes HBV replication and progeny secretion via enhancing endosomal trafficking and blocking autophagic degradation. Autophagy 2021:1-18.
2. Lin Y, Wu C, Wang X, Liu S, Zhao K, Kemper T, Yu H, et al. Glucosamine promotes hepatitis B virus replication through its dual effects in suppressing autophagic degradation and inhibiting MTORC1 signaling. Autophagy 2019:1-14.







 鄂公网安备 42030202000293号
鄂公网安备 42030202000293号